
Suponhamos, por exemplo, que separemos fisicamente a barra de zinco de uma solução de sulfato de cobre. O zinco é imerso numa solução de sulfato de cobre, assim como uma barra de cobre. As duas barras encontram-se interligadas eletricamente mediante um fio. Este dispositivo forma uma pilha.
As barras de zinco e de cobre são denominadas eletrodos e fornecem a superfície na qual ocorrem as reações de oxidação e de redução. Se os eletrodos de zinco e o cobre forem ligados entre si, por meio de um circuito externo, haverá um escoamento de elétrons através desse circuito, do eletrodo de zinco para o de cobre, em cuja superfície serão recebido pelos íons Cu+2. (lembra-se da fila de reatividade!).
E esses íons serão reduzidos e os átomos de cobre se depositaram na superfície do eletrodo de cobre (eletrodeposição).Nesta célula o eletrodo de zinco é denominado ânodo. O ânodo é um eletrodo no qual ocorre a oxidação:
Zn(s) 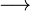 Zn2+ + 2e– (reação anódica)
Zn2+ + 2e– (reação anódica)
O elétrodo de cobre, nesta composição, será o cátodo, um eletrodo no qual se realiza a redução.
2e– + Cu2+ 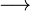 Cu(s) (reação catódica)
Cu(s) (reação catódica)
Logo,
- Ânodo = local onde ocorre oxidação
- Cátodo = local onde ocorre redução
À medida que se vai realizando a reação da célula, os íons de zinco migram afastando-se do ânodo de zinco, em direção do eletrodo de cobre, à semelhança do que ocorre com os íons de cobre. A pilha pode conter uma parede permeável ou uma ponte salina (com cloreto de potássio, os íons Cl– migram em direção ao ânodo e os íons K+ migram em direção ao cátodo) que fazem o contato entre as duas células. As reações de eletrodo e a reação da célula são:
- Ânodo : Zn (s)
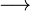 Zn2+ + 2 e–
Zn2+ + 2 e– - Cátodo : 2 e– + Cu2+
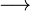 Cu(s)
Cu(s) - Reação Global da Célula: Zn(s) + Cu2+
 Zn2+ + Cu(s)
Zn2+ + Cu(s)

Nenhum comentário:
Postar um comentário